Дана стаття доступна лише мовою оригіналу (російською).
Несмотря на огромные усилия и значительные достижения в области общественного здравоохранения, борьба с инфекционными заболеваниями остается сложной задачей. Инфекционные заболевания создают значительный риск для здоровья человека и приводят к четверти смертельных случаев во всем мире (1,2). Коронавирусы являются представителями обширного семейства Coronavivridаe из отряда Nidovirales, подсемейства Cornidovirineae и могут вызывать респираторные заболевания (3). Первый коронавирус был открыт в 1931 году (вирус инфекционного бронхита, IBV – Infectious bronchitis virus) или коронавирус птиц, а в 1965 году открыты коронавирусы человека (HCоV – Human Coronaviruses). До настоящего времени были идентифицированы шесть коронавирусов человека (HCoV), а именно HCoV-229E, HCo-HKU1, HCoV-OC43, HCoVNL63, а также вирусы, которые относятся к особо опасным SARS-CoV (коронавирус тяжелого острого респираторного синдрома) и MERS-CoV (коронавирус ближневосточного респираторного синдрома) (4,5).
Первый случай появление нового коронавируса SARS-CoV-2 выявлен 12 декабря 2019 года в городе Ухань (провинция Хубей, КНР). Он представляет собой одноцепочечный РНК-содержащий вирус и относится к семейству Coronaviridae, линии Beta-CoV B. Как и другие представители этого семейства - SARS-CoV и MERS-CoV относится к II-й группе патогенности. Генетическая последовательность SARS-CoV-2 сходна с последователь-ностью SARS-CoV по меньшей мере на 70%. По состоянию на конец марта 2020 г. SARS-CoV-2, вызывающий опасное инфекционное заболевание COVID-19, проник уже в 168 стран и территорий мира, им заразилось около 300 тысяч человек, более 13 тысяч скончались.
Морфология вирионов коронавирусов.
Оболочечные вирусные частицы имеют округлую плеоморфную форму. Булавовидные поверхностные пепломеры, формирующие «зубцы короны» длиной из тримеров гликопротеина S. Белок М является трансмембранным. Пентамеры белка Е формируют ионные каналы и представляют собой важный фактор вирулентности коронавирусов. Нуклеокапсид спиральной симметрии формируется фосфорилированным белком N в комплексе с геномной вирионной РНК (6) (рис.1).
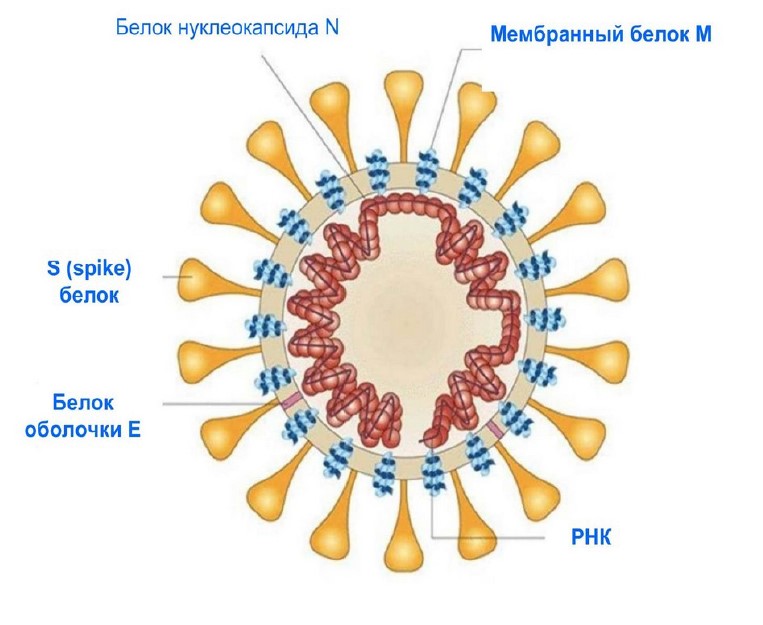
Рис.1. Принципиальная схема структуры коронавируса SARS.
- Сферические частицы диаметром 120 нм;
- Оболочка вириона содержит булавовидные отростки (S–поверхностный гликопротеин, обеспечивает проникновение в клетку);
- Белки оболочки E (сборка и выход);
- Мембранный белок M (форма вириона);
- Нуклеокапсидныйбелок N;
- Геном + РНК длиной примерно 30000 нт;
- РНК содержит кэпструктуру и поли А последовательность (чтобы не распознаваться системами внутриклеточного иммунного ответа, разрушающими РНК, не имеющими таких структур).
Жизненный цикл коронавирусов представлен на рисунке 2.
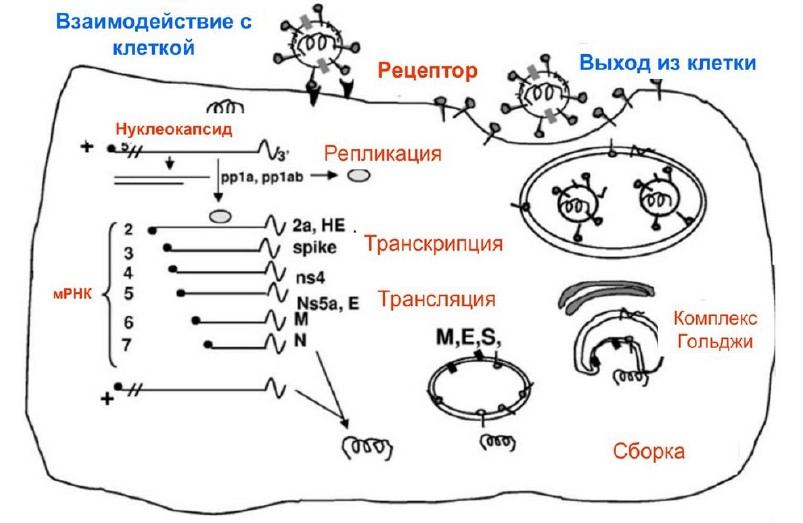
Рис. 2. Жизненный цикл коронавирусов.
- Проникновение вируса в клетку с помощью S белка (рецептор для 2019-nCoV–ангиотензин-связывающий белок);
- Трансляция полипротеинов и процессинг репликативного комплекса;
- Репликация и транскрипция вируса;
- Синтез структурных белков;
- Сборка и отпочковывание вирусных частиц от ЭПР и комплекса Гольджи;
- Выход вируса посредством экзоцитоза.
С помощью сканирующего трансмиссионного электронного микроскопа представлено изображение вируса SARS-CoV-2, выделенного у пациента из США (рис.3).
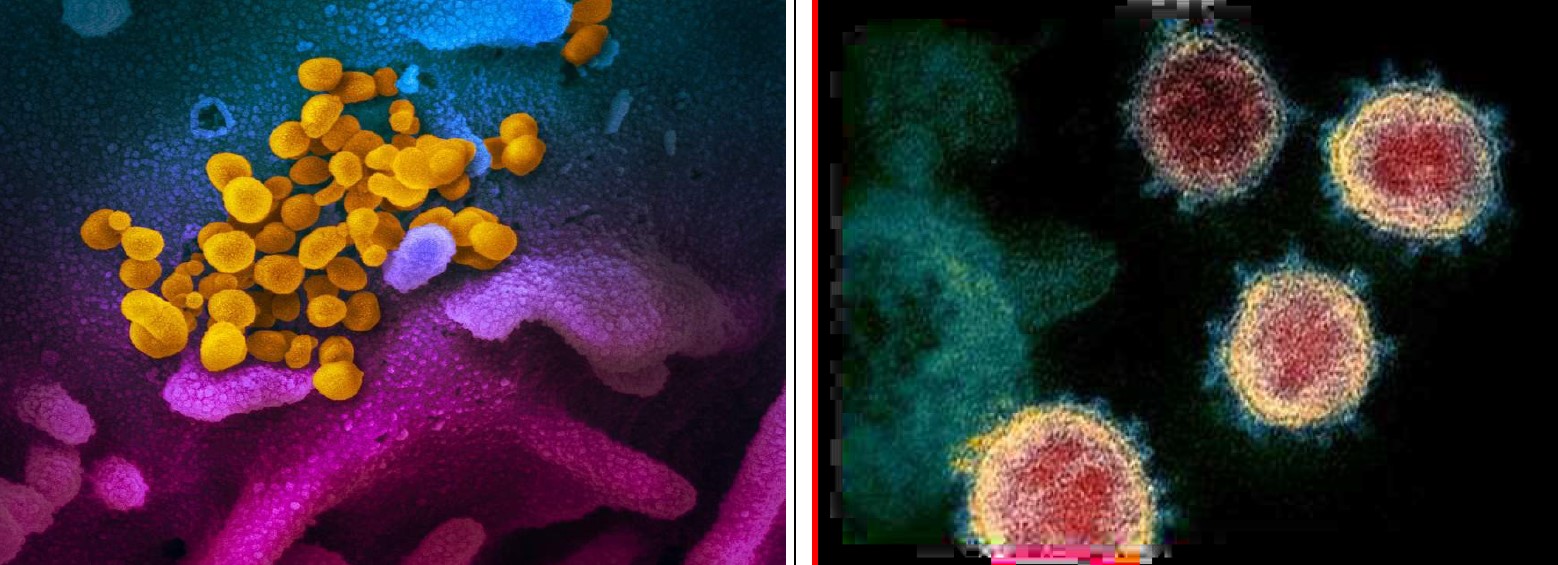
Рис.3. Изображение вируса SARS-CoV-2, вызывающего COVID-19 (желтый) на поверхности культивируемых клеток (синий/розовый).
Патогенез новой коронавирусной инфекции COVID-19.
Размножение вируса происходит в эпителии верхних и нижних дыхательных путей с диф-фузным повреждением альвеоцитов и развитием пневмонии. При этом вирус вызывает повышение проницаемости клеточных мембран и усиленный транспорт жидкости, бога-той альбумином в интерстициальную ткань легкого и просвет альвеол с развивтием интер-стициального и альвеолярного отека. Разрушается сурфактант, что ведет к коллапсу аль-веол. В результате резкого нарушения газообмена развивается острый респираторный дисстресс-синдром (ОРДС).
Предполагается, что SARS-CoV-2 (рис.4) (вверху слева) передаются через промежуточного хозяина для заражения дыхательных путей человека (вверху справа). При инфекция (нижняя панель) происходит взаимодействие шипов S-белка с рецепторами ангиотензинпревращающего фермента (АСЕ-2). Впоследствии поверхностные протеазы расщепляют S2, опосредующую слияние субъединицы S, которая запускает серию конформационных изменений, которые приводят к слиянию между вирусной оболочкой и мембраной клетки-мишени (7).
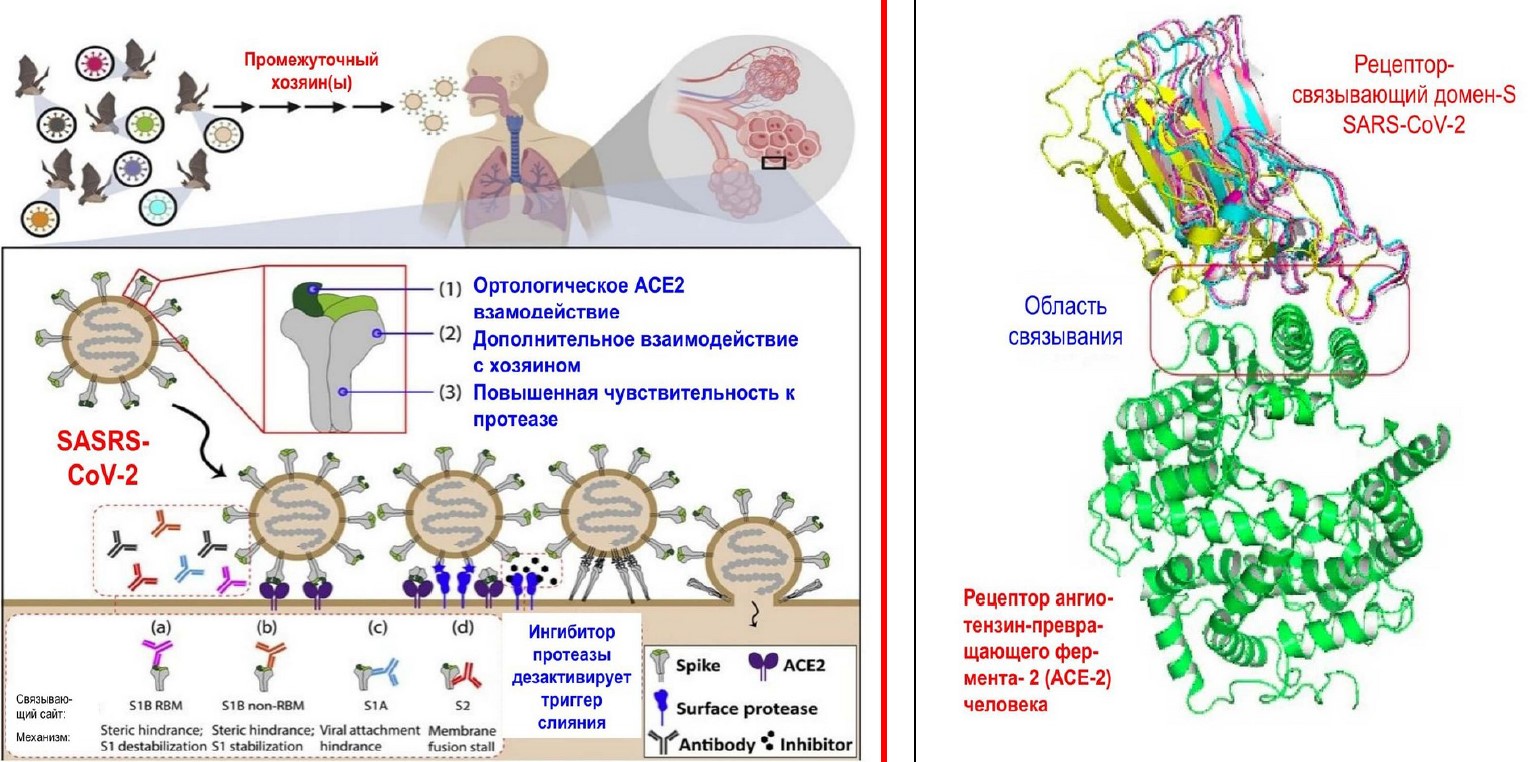
Рис. 4. Механизм проникновения SARS-CoV-2 в клетку и связывание с рецептором АСЕ-2.
Клинические особенности коронавирусной инфекции COVID-19 представлены в табл 1.
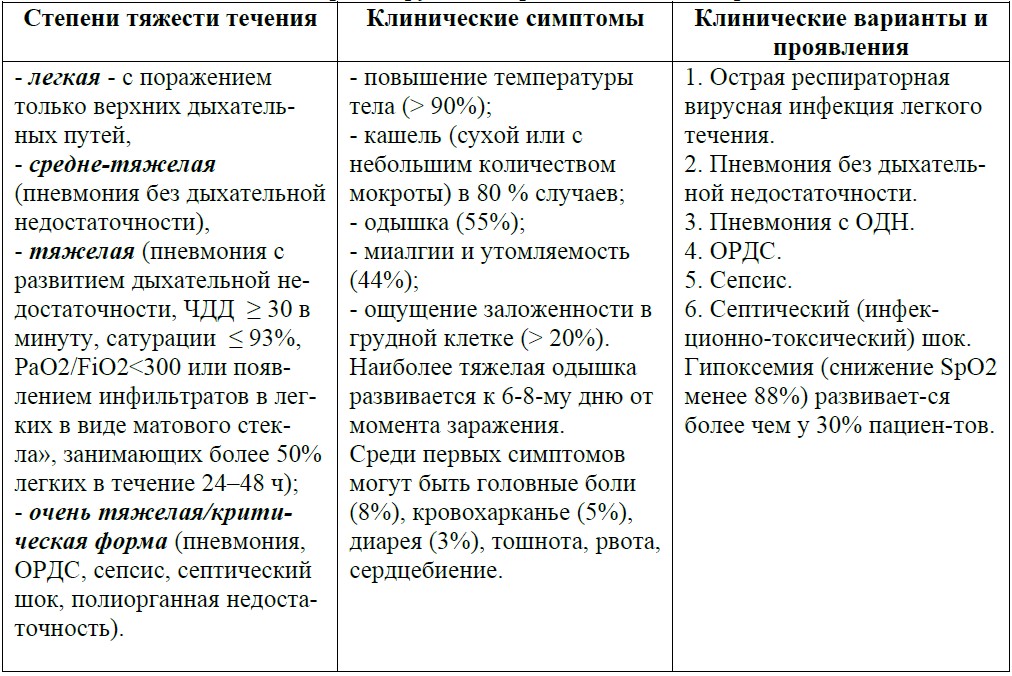
Табл. 1. Клинические особенности коронавирусной инфекции COVID-19.
В группу риска тяжелого течения заболевания входят люди старше 60 лет, пациенты с сахарным диабетом, болезнями органов дыхания, сердечно-сосудистой системы и онкологическими заболеваниями. Летальность составляет от 1 до 4 %.
В настоящее время основным источником инфекции является больной человек, в том числе находящийся в инкубационном периоде заболевания. Коронавирус имеет относительно низкую вирулентность – т.е. для инфицирования необходимо достаточно
В продолжительное время контакта с больным человеком (более 15 минут). Больной может заразить от 0 до 11 других людей. Средний инкубационный период 5-6 дней, однако может затянуться и до 14 дней, а по некоторым данным и до 24 дней. Скрининг на коронавирусную инфекцию при помощи безконтактного измерения температуры не очень эффективен, потому что во время инкубационного периода (т.е. уже после заражения, но еще до начала появления клинических симптомов) температура у зараженного остается нормальной. По опубликованным литературным данным, у 81% заболевших клиника легкая (они могут лечиться дома, главное – носить маску для ограничения инфицирования других, не выходить на улицу, не ходить в магазины и другие людные места). У 14% клиника тяжелая (они требуют госпитализации и возможно ингаляции кислорода для насыщения им крови), у 5% клиника критическая (они госпитализируются в реани-мационные отделения). У заболевших коронавирусом людей средняя длительность от момента диагностики до прекращения выделения вируса составляет 20 дней (интерквартильный размах от 17 до 24 дней, максимальная длительность 37 дней). Поэтому перед выпиской, вне зависимости от наличия или отсутствия симптомов необходимо лабораторное тестирование - перестал ли выделяться коронавирус.
Алгоритм обследования пациента с подозрением на новую коронавирусную инфекцию, вызванную COVID-2019.
Диагноз устанавливается на основании наличия клинических признаков COVID-19, данных эпидемиологических анамнеза, клинического обследования и результатов лабораторных исследований.
ЛАБОРАТОРНАЯ ДИАГНОСТИКА КОРОНАВИРУСНОЙ ИНФЕКЦИИ COVID-19.
Лабораторную диагностику COVID-19 разделяют на общую и специфическую (табл.2).
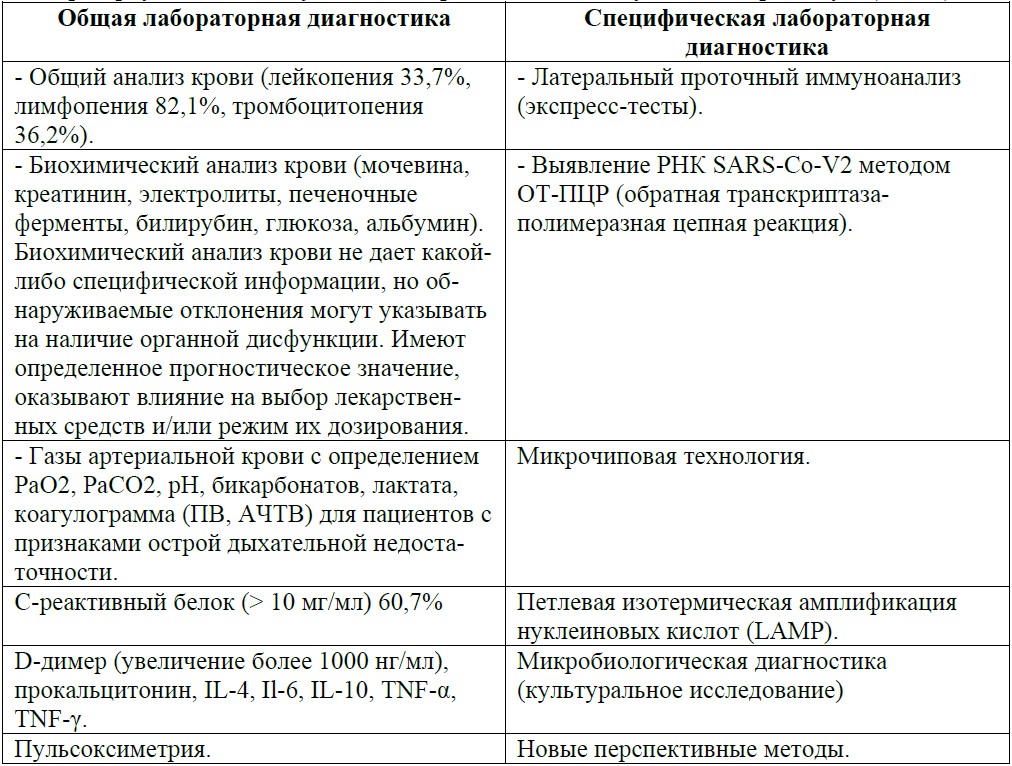
Табл.2. Общая и специфическая лабораторная диагностика COVID-19.
Отбор и транспортировка образцов для лабораторной диагностики COVID-19.
Рекомендации Всемирной Организации Здравоохранения (ВОЗ) для сбора и хранения образцов для лабораторного тестирование на COVID-19 представлены в таблице 3 (8).
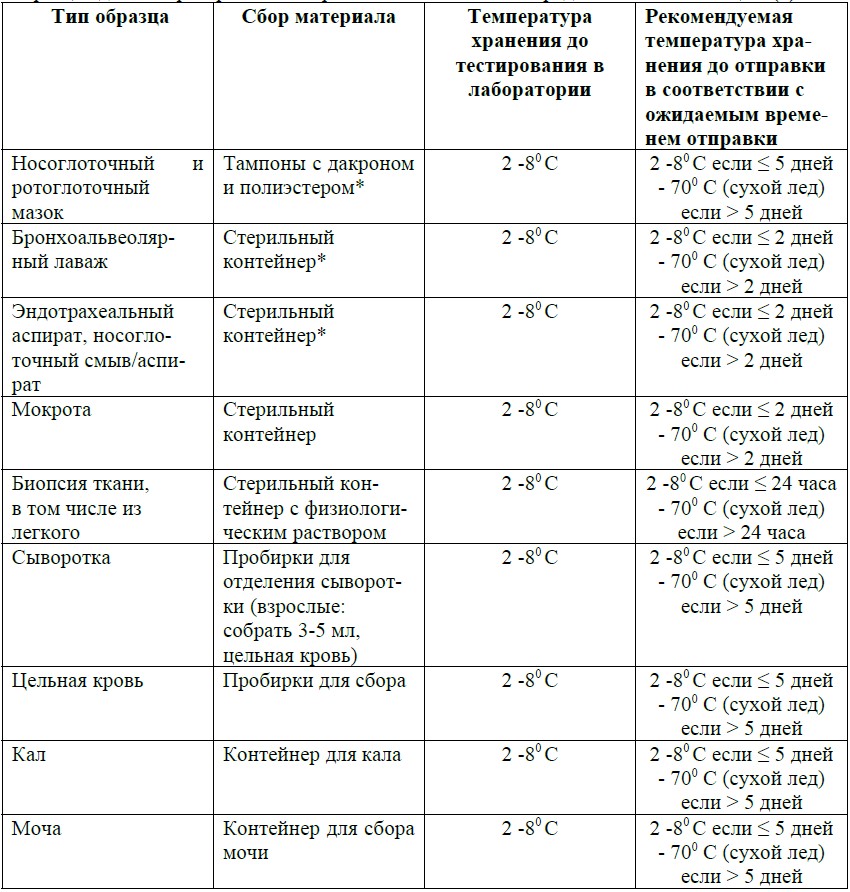
Табл. 3. Сбор и хранение образцов для тестирования COVID-19.
(* Для транспортировки образцов для обнаружения вируса используйте транспортную среду (VTM), содержащую противогрибковые и антибиотические добавки. Избегайте повторного замораживания и оттаивания образцов. Если VTM не доступен, может использоваться стерильный физиологический раствор вместо VTM (в этом случае продолжительность хранения образца при 2-8 ° C может отличаться от указанной выше).
Рекомендуется использование образцов материала из верхних дыхательных путей, например, носоглоточных и ротоглоточных мазков, для выявления вируса. Однако, необходимо следить за тем, чтобы носоглоточные мазки брались не просто из ноздрей, а непосредственно из носоглотки. Для взятия мазков из носоглотки и ротоглотки должны
В использоваться предназначенные для этой цели зонды, снабженные пробиркой с вирусологической транспортной средой. По возможности следует брать пробы как из верхних, так и из нижних дыхательных путей. Для подтверждения отсутствия вируса у клинически выздоровевших пациентов следует продолжать отбор образцов материала из дыхательных путей вплоть до получения двух подряд отрицательных результатов исследования. Частота взятия образцов зависит от конкретных обстоятельств. Тем не менее, их следует отбирать не реже одного раза в 2-4 дня. Если для перевода пациента из изолятора требуется несколько отрицательных результатов ПЦР-диагностики подряд, отбор образцов может выполняться ежедневно. Для выявления антител и подтверждения инфекции требуется анализ парных образцов сыворотки, однако одинарные образцы могут также быть использованы для выявления случаев с подозрением на заражение. По возможности парные образцы сыворотки следует отбирать с промежутком от 14 до 21 дня. При этом первый образец должен быть взят в течение первой недели заболевания. При использовании только одной пробы сыворотки, ее необходимо брать по меньшей мере через 14 дней после обнаружения симптомов заболевания.
СПЕЦИФИЧЕСКАЯ ЛАБОРАТОРНАЯ ДИАГНОСТИКА КОРОНАВИРУСНОЙ ИНФЕКЦИИ SARS-CoV-2.
I. Латеральный проточный иммуноанализ (экспресс-тесты).
Для диагностики острых инфекций существует лаг-период, так как антитела против вируса обычно появляются через 7 -14 дней после начала заболевания. Иммуноанализ с использованием тест-полосок может обеспечить быстрое качественное обнаружение антител для скрининга с последующим проведением подстверждающих тестов. Исследователи из Сингапура (Медицинская школа Duke-NUS) разработали тесты для определения антител к SARS -CoV-2 (9,10). Тест-полоски для быстрого определения антител IgM (руководитель Dr Zhong Nanshan, Гуанчжоуский медицинский университет) используются в Китае (11). Такие компании как Guangzhou Wondfo Biotech и Innovita Biological Technology получили одобрение EUA от Китайской национальной медицинской службы по надзору за продукцией для применения их наборов при определении антител (12-15). Компания Guangzhou Wondfo Biotech также получила знак CE для набора Wondfo SARS-CoV-2 для определения антител (метод латерального потока), который тестирует антитела IgM и IgG (16,17). Компания Pharmact AG из Германии (18), Zhejiang Orient Gene Biotech (19,20) и SD Biosensor (21) имеют коммерчески доступные тест-полоски для иммуноанализа для качественного обнаружения антител, которые могут использоваться для тестирования в месте оказания медицинской помощи. Также предпринимаются другие усилия по разработке и коммерциализации наборов для экспресс-тестирования Jiangsu Medomics Medical Technologies (22) Shenzhen Tisenc Medical Devices (23) и Nankai University (24). Ожидается, что время проведения с использованием этих тест-полоскок будет от 15 до 20 минут, что значительно меньше по сравнению с использованием ОТ-ПЦР. Компания Jiangsu Medomics Medical Technologies разработала иммуноанализ латерального потока в месте оказания медицинской помощи, который одновременно обнаруживает антитела IgM и IgG против SARS-CoV-2.
Экспресс-кассета IgG/IgM 2019-nCoV (цельная кровь/сыворотка/плазма) представляет собой иммунохроматографический анализ с боковым течением. В тесте используются антитела против IgM человека (тестовая линия IgM), IgG против человека (тестовая линия IgG) и анти-кроличьи IgG (контрольная линия C), иммобилизованные на нитроцеллюлозной мембране. Подложка для конъюгата бордового цвета содержит коллоидное золото, конъюгированное с рекомбинантными антигенами COVID-19, конъюгированным с коллоидным золотом и кроличьими конъюгатами IgG-золота. Когда образец, за которым следует буфер для анализа, добавляют в лунку образца, антитела IgM и / или IgG, если они присутствуют, будут связываться с конъюгатами COVID-19, образуя комплекс антигенных антител. Этот комплекс мигрирует через нитроцеллюлозную мембрану под действием капиллярной силы. Когда комплекс встречается с линией соответствующего иммобилизованного антитела (человеческого IgM и/или человеческого IgG), происходит его захват. При этом образуется полоска бордового цвета, что подтверждает положительный результат теста. Отсутствие цветной полосы в тестовой области свидетельствует об отрицательном результате. Тест содержит внутренний контроль (С-полоса), который должен иметь бордовую цветную полосу иммунокомплексного козьего анти-кроличьего IgG/кроличьего IgG-конъюгата золота независимо от развития цвета на любой из тестируемых полос. В противном случае результат теста является недействительным и образец должен быть повторно протестирован на другом устройстве (Рис. 5).
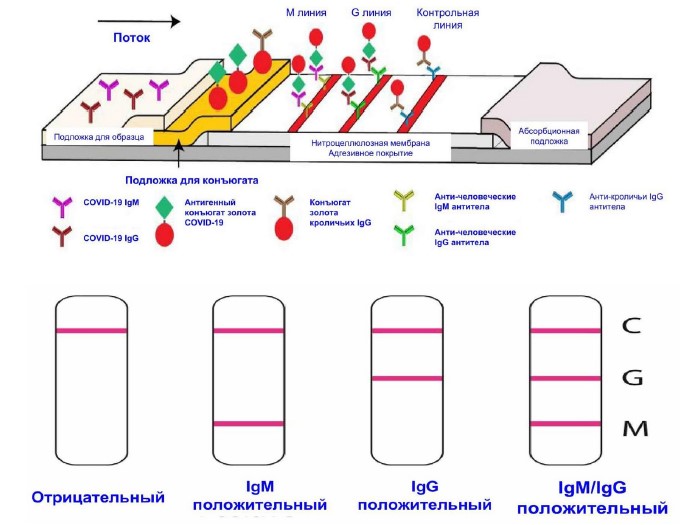
Рис.5. Схематическая иллюстрация быстрого комбинированного теста на антитела SARS-CoV-2 IgM-IgG. Иллюстрация различных результатов тестирования.
Непосредственно процедура проведения теста представлена на рисунке 6.
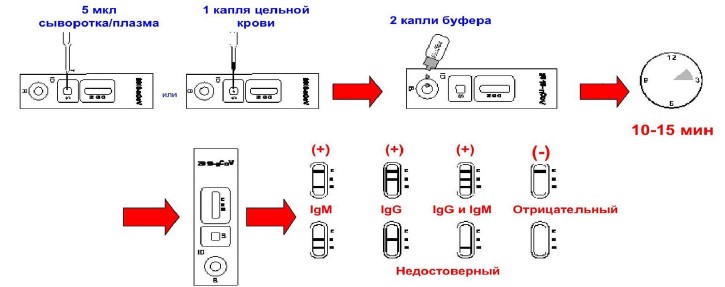
Рис.6. Процедура проведения теста.
Репрезентативное фото для различных результатов анализа крови пациентов прдеставлено на рисунке 7.
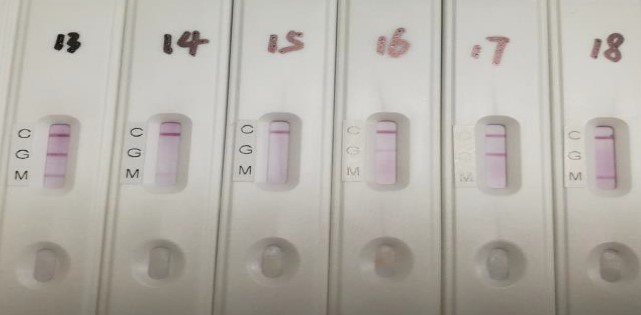
Рис. 7. Фото различных результатов анализа крови пациента.
(№ 13 - IgM и IgG положительный, № 14 - IgM слабоположительный, № 15 - IgM и IgG отрицательные, № 16 - IgG слабоположительный, № 17- IgG положительный, № 18 - IgM положительный).
Преимущества
Этот новый набор для быстрого тестирования комбинированных антител SARS-CoV-2 IgG-IgM имеет несколько преимуществ. По сравнению с методом ОТ-ПЦР он экономит время и не требует оборудования, простой в исполнении и требует лишь минимального обучения. Этот анализ может быть выполнен у постели больного, в любой клинике или лаборатории, в аэропорту или на вокзале (25). Для внеклинического скрининга будет удобнее использовать кровь из пальца или пятки вместо крови из вены. Другим потенциальным применением этого теста является скрининг бессимптомных носителей SARS-CoV-2, которые могут распространять данный вирус (26,27). Этот набор для тестирования комбинированных антител IgM/IgG дает возможность проводить крупномасштабный скрининг бессимптомных носителей. По крайней мере, некоторые, если не все носители, вероятно, имеют антитела против SARS-CoV-2, что продемонстри-ровано бессимптомными носителями вируса Зика (28). Поскольку этот тест может одновременно определять IgM и IgG, его можно использовать как для ранней диагностики (IgM), так и для мониторинга во время лечения. Инфекция SARS-CoV-2 начинается в легких, а не в верхних дыхательных путях (29), поэтому отбор проб на ранней стадии инфекции с использованием мазка из горла или мокроты может не обнаружить вирус. Это одно из возможных объяснений высоких ложноотрицательных результатов в тесте ОТ-ПЦР.
Ограничения.
Причины ложноотрицательных результатов могут быть связаны, во-первых, с низкими концентрациями антител. Когда уровни IgM и IgG ниже предела обнаружения (пока не определено) результаты теста будут отрицательными. Во-вторых, разница в выработке антител индивидуального иммунного ответа может быть одной из причин ложноотрицательных результатов у пациентов с COVID-19. И последнее, но не менее важное: антитела IgM снижаются и исчезают через 2 недели. В некоторых случаях трудно точно знать, когда пациент был инфицирован или как долго он был инфицирован. Таким образом, когда пациент проходил тестирование, уровень IgM мог быть значительно ниже его пика и не обнаруживаться этим тестом.
II. ОТ-ПЦР (обратная транскриптаза - полимеразная цепная реакция).
Для обнаружения вирусного генетического материала Китайские органы здравоохранения опубликовали полный геном SARS-CoV-2 в GenBank и на портале GISAID (30) (рис.8).
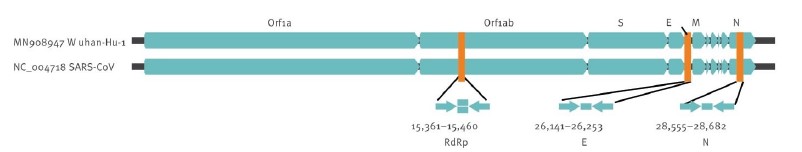
Рис.8. Относительные положения ампликон-мишеней на коронавирусе SARS и новом геноме коронавируса 2019.
ВОЗ на своей веб-странице опубликовала пять протоколов диагностики с применением полимеразной цепной реакции с обратной транскрипазой. К ним относятся протоколы Института вирусологии Charité в Германии и Гонконгского университета (HKU), а также протоколы из Таиланда, Японии и Китая. Шестой протокол Центров США по контролю и профилактике заболеваний (CDC) был добавлен на веб-страницу ВОЗ 29 января 2020 года (31). С тех пор веб-страница ВОЗ была обновлена с использованием другого URL-адреса и дополнена руководящими документами (32). Седьмой протокол их Института Пастера в Париже (Франция) был добавлен в марте 2020 года (33). Следует отметить, что протоколы диагностики с использованием ОТ-ПЦР, опубликованные на веб-странице ВОЗ, являются именно Руководствами, а не исчерпывающими документами. Различные учреждения и Правительства разработали свои собственные протоколы, которые ВОЗ может не публиковать на своих старницах.
Первый валидированный диагностический тест был разработан группой профессора Christian Drosten’s из Института вирусологии Charité в Берлине (34). Первоначальный дизайн анализа ОТ-ПЦР основан на совпадении вирусов SARS-CoV или SARS с вирусом из Уханя. Для диагностики использовали RdRP и E гена, где Е выступал в качестве инструмента первой линии, а анализ гена RdRp - в качестве подтверждающего. Все анализы были высокочувствительными и специфичными, не реагировали перекрестно с другими коронавирусами, а также с клиническими образцами человека, которые содержа-ли респираторные вирусы.
US CDC поделился протоколом для анализа ОТ-ПЦР с праймерами и зондами, предназначенными для универсального обнаружения SARS-подобного коронавируса и специфического обнаружения SARS-CoV-2 (35,36).
Некоторые группы исследователей также поделились своими протоколами. В некоторых случаях они будут готовы отправлять реагенты или смеси реагентов с соответсвующей оплатой или без нее (Табл.3).
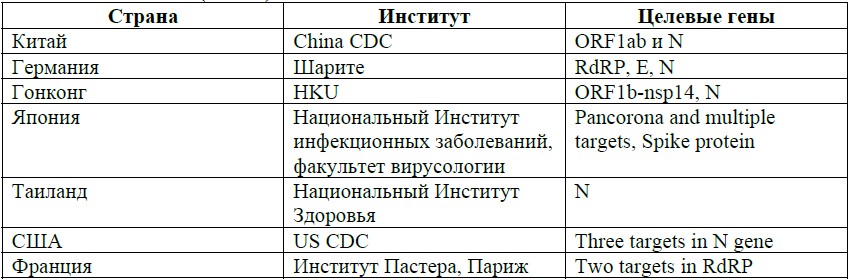
Табл.3. Сводная таблица доступных протоколов для диагностки SARS-CoV-2.
Тест концерна ROCHE под торговым наименованием cobas® SARS-CoV-2 получил разрешение на экстренное использование (Emergency Use Auhtorization – EUA) Управления по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration, FDA) и будет доступен на рынках, поддерживающих маркировку «СЕ». Об этом компания сообщила 2 марта 2020 г. Молекулярный тест на SARS-Co-2 позволит провести ускоренное тестирование при помощи автоматизированных систем Roche Сobas® 6800 и Сobas® 8800. Их пропусканная способность позволяет получать 1440 результатов (Сobas® 6800) и 4128 результатов (Сobas® 8800) за 24 часа. При этом результаты первых 96 тестов получают через 3,5 часа, а в дальнейшем – по 96 тестов каждые 30 или 90 минут. Больницы и референтные лаборатории могут проводить тестирование на полностью автоматизированных системах Roche Сobas® 6800 и Сobas® 8800, которые широко доступны в США и во всем мире.
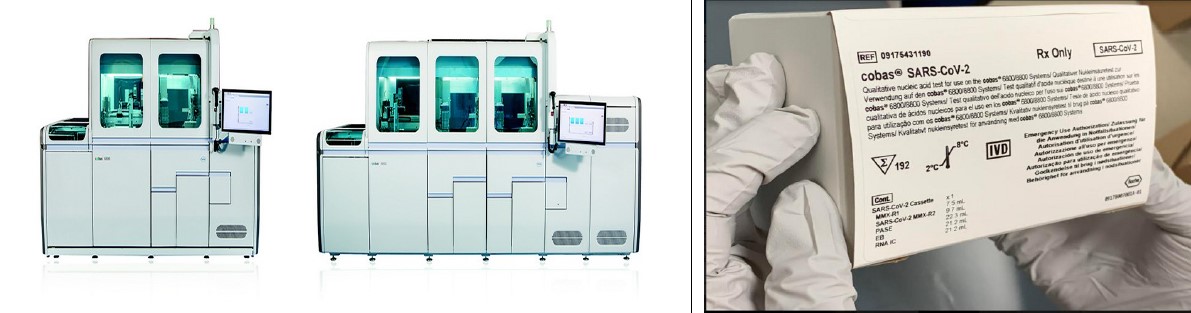
Рис.9. Автоматизированные системы Roche Сobas® 6800, Сobas® 8800 и набор cobas® SARS-CoV-2 для выявления COVID-19.
Многими международными организациями с помощью ОТ-ПЦР тест- систем коронавирус SARS-Co-V2 рекомендуется выявлять по следующим генетическим маркерам - RdRP-gene, N-gene и Е-gene.
Процедура проведения теста для выявления SARS-CoV-2 гибридизационно-флуоресцентной детекцией.
Выявление РНК SARS -CoV-2 методом ОТ-ПЦР с гибридизационно-флуоресцентной детекцией включает в себя три этапа: экстракцию РНК из образцов исследуемого материала, реакцию обратной транскрипции и амплификацию участка кДНК данного коронавируса с гибридизационно-флуоресцентной детекцией, которая производится непосредственно в ходе ПЦР. Экстракция РНК из биологического материала проводится в присутствии внутреннего контрольного образца, который позволяет контролировать выполнение процедуры исследования для каждого образца. Отдельно используется положительный контроль экстракции и отрицательный контроль экстракции РНК. Реакция обратной транскрипции проводится с целью образования комплементарной ДНК (кДНК) на матрице РНК. Затем с полученными пробами кДНК проводится реакция амплификации участков при помощи специфичных к этим участкам кДНК праймеров и фермента Taq-полимеразы. В составе реакционной смеси присутствуют флуоресцентно-меченые олигонуклеотидные зонды, которые гибридизуются с комплементарными участками амплифицируемых мишеней кДНК, в результате чего происходит нарастание интенсивности флуоресценции. Это позволяет регистрировать накопление специфи-ческого продукта амплификации путем измерения интенсивности флуоресцентного сиг-нала. Детекция флуоресцентного сигнала осуществляется непосредственно в ходе ПЦР с помощью амплификатора с системой детекции флуоресцентного сигнала в режиме «реального времени».
Пример процедуры проведения теста для детекции 3-х генов представлен на рисунке 10.

Рис.10. Процедура проведения теста и интерпретация результатов для определения 3-х генов нового коронавируса COVID-19 с использованием метода ОТ-ПЦР.
Ограничения ПЦР
Несколько последовательных отрицательных результатов тестирования совсем не исключают возможности наличия инфекции. К появлению ложноотрицательных результатов приводит ряд факторов:
- низкое качество образцов;
- образец был взят слишком рано или слишком поздно в течение заболевания;
- при обращении с образцом или в ходе его транспортировки не были соблюдены необхо-димые требования;
- технические факторы, связанные с выполнением теста, например мутация вируса или ингибирование ПЦР.
III. Методы на основе микрочипов.
Метод обнаружения коронавируса на основе микрочипов, является быстрым, с высокой пропускной способностью анализом. Принцип метода состоит в том, что с помощью обратной транскриптазы РНК коронавируса продуцирует кДНК, меченную специфически-ми зондами. Затем эти меченные кДНК помещаются в лунки и гибридизуются с твердо-фазными олигонуклеотидами, закрепленными на микрочипе с последующей промывкой для удаления свободных ДНК. В результате РНК коронавируса может быть определена путем исследования специфических зондов (37). Shi et al. (38) разработали 60-мерный олигонуклеотидный микрочип и успешно применили его для обнаружения коронавируса ОРВИ Тем не менее, учитывая быструю мутацию SARS-CoV исследователи Guo et al. (39) разработали микрочип для обнаружения однонуклеотидного полиморфизма (SNP) мутации в гене spike (S) SASRS-CoV с точностью, составляющую 100%. Поскольку коронавирус может привести к внезапной вспышке эпидемии, большое значение имеет обнаружение широкого спектра коронавирусов. При этом диагностика должна проводиться Point of Care (анализ по месту лечения). В связи с этим Luna et al. (40) разработали недорогой нефлуоресцентный олигонуклеотид низкой плотности для обнаружения всего рода коронавирсов с чувствительностью равной ОТ-ПЦР в реальном времени. Hardick et al. (41) создали новую, портативную POC-диагностическую платформу на основе микрочипов - Mobile Analysis Platform (MAP), которая имеет отличные показатели в выявлении вирусов и допустимы предел обнаружения.
Уникальная технологическая платформа компании Randox позволяет используя техноло-гию Biochip проводить экспресс-анализ SARS-CoV-2, обрабатывая одновременно 54 образца пациентов, представляя результаты 540 анализов в течение 5 часов на анализаторе Evidence Investigator (рис.11).

Рис.11. Биочип и анализатор Evidence Investigator компании Randox для обнаружения SARS-CoV-2.
IV. Петлевая изотермическая амплификация нуклеиновых кислот (LAMP).
Петлевая изотермическая амплификация (LAMP) является новым методом амплификации нуклеиновых кислот, которая был разработана Tsugunori Notomi и его коллегами в 2000 г. (42). Сущность данного метода заключается в удвоении участка ДНК с высокой специфичностью, эффективностью и скоростью в условиях постоянной температуры. При совмещении с обратной транскрипцией, LAMP может с высокой эффективностью амплифицировать РНК последовательности. Данный метод основан на автоматическом цикле синтеза ДНК цепи со смещением при использовании ДНК-полимераз с высокой активностью смещения и четырех (шести) специально созданных праймеров. Четыре праймера сконструированы таким образом, чтобы быть нацеленными на шесть определенных регионов гена-мишени. LAMP-анализ является быстрым, не требует дорогостоящего оборудования и реагентов, что может снизить стоимость обнаружения коронавируса (43). Poon et al. (44) сообщили о простом LAMP-анализе и продемонстрировали возможность использовать данную технологию для обнаружения SARS-CoV. Область ORF1b SARS-CoV была выбрана для диагностики SARS и усилена LAMP-реакцией в присутствии 6 праймеров, после чего амплифицированные продукты біли проанализированы с помощью электрофореза. Частота обнаружения и чувстви-тельность к SARS -CoV в анализе LAMP аналогична обычным методам на основе ПЦР. Анализ RT-LAMP разработан Shirato et al (45), который способен обнаруживать всего 3 копии РНК MERS-CoV и является высокоспецифичным без перекрестной реакции с другими респираторными вирусами. Thai et al (46) разработали одношаговую единичную пробирку для количественного анализа RT-LAMP в реальном времени с измерением окрашивания раствора для ранней и быстрой диагностики SARS-CoV. Этот анализ в 100 раз более чувствительный, чем обычная ОТ-ПЦР.
В работе Zhang et al (47) представлено тестирование и валидизация 5 наборов праймеров LAMP как целевых для двух фрагментов SARS-CoV-2 с использованием коротких (~300 bp) РНК фрагментов, полученных транскрипцией in vitro и образцов РНК пациентов (рис.11).
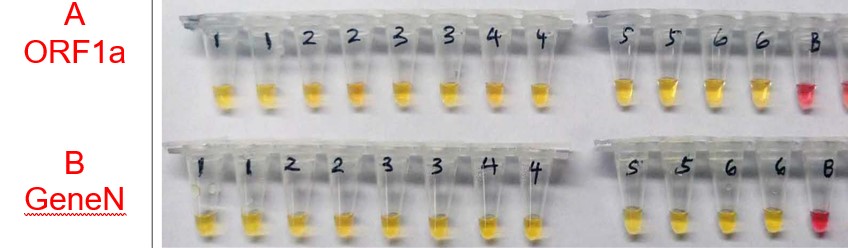
Рис.11. Обнаружение SARS-CoV-2 в образцах пациентов из г.Ухань (Китай) с использованием колориметрического анализа LAMP с таргетными праймерами против ORF1a (A) и GeneN (B). Желтый цвет указывает на положительное обнаружение через 30 минут инкубации, а розовый цвет – отрицательный результат.
V. Культивирование вируса.
ВОЗ не рекомендует культивирование вируса в качестве рутинной диагностической процедуры.
VI. Перспективные методы для диагностики SARS-CoV-2.
РНК-таргетированный CRISP-ассоциированный фермент Cas13 недавно был адаптирован для быстрого определения нуклеиновых кислот (48,49). C.A. Freije et al. (50) показали, что Cas13 может быть запрограммирован для разрушения геномов разнообразных вирусов одноцепочечной РНК (рис12).
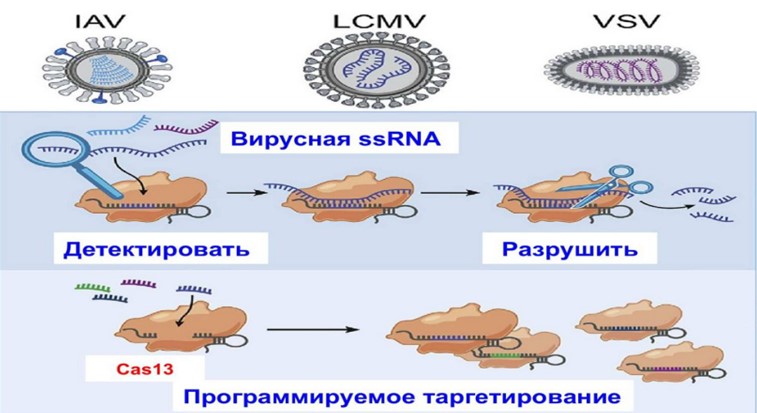
Рис.12. Программирование и использование Cas13 для разрушения геномов разнообраз-ных вирусов.
Они разработали платформу, названную SHERLOCK (специфический высокочувст-вительный ферментативный репортер разблокировки), которая объединила изотермии-ческую преамплификацию с Cas13 для обнаружения отдельных молекул РНК или ДНК (51). Их последний протокол для COVID-19 под названием «Протокол обнаружения COVD-19 с использованием диагностики CRISP» опубликован на веб-сайте (https://broad.io/sherlockprotocol ), что может представлять интерес для исследователей в дальнейшем развитии данной системы диагностики и как платформу для обнаружения нуклеиновых кислот.
Заключение
Для подтверждения случаев COVID-19 такие клинические симптомы как лихорадка, кашель, миалгия или повышенная усталость не являются уникальными признаками, так как они могут быть похожими на симптомы других вирусных заболеваний – ОРВИ, грипп и др. В настоящее время для подтверждения COVID-19 основным инструментом является использование лабораторных методов исследования. К ним относятся латеральная иммунодиффузия (экспресс-тесты), ОТ-ПЦР, микрочиповая технология и др. При этом очень важно выбрать методы обнаружения ввиду того, что каждый метод имеет свои уникальные преимущества и, безусловно, недостатки.
Мельник А.А., к.б.н.
Ваш email не буде опубліковано. Обов'язкові поля відмічено*











Немає коментарів